《中国糖尿病杂志》官方网站

来自:中国糖尿病资讯网 编辑:admin|点击数:|2011-12-01
·国际研究进展·
点评(方福德教授):微小RNA(microRNA,miRNA)是非编码RNA中一类目前研究最活跃、最深入、发展最快的调控性RNA,其对基因表达的主要调控机制已经明了。由于其表达和对靶基因调控的改变而涉及到的疾病很广泛,该领域研究已经成为国际医学和生命科学中最重要的趋势和方向之一。有鉴于此,糖尿病学界前辈和著名专家钱荣立教授一直高度关注这方面的动态与进展,并亲自编译了“糖尿病分子生物学研究的新领域:微RNAs (miRNAs)与β-细胞生物学、胰岛素抵抗、糖尿病及其并发症”一文,以飨读者。该文简明扼要地归纳了近年来相关研究的主要成果,展望了进一步研究的前景,帮助读者了解相关研究的概况,具有重要的参考价值,值得大家一阅。
钱荣立 金世鑫 编译
作者单位:100034北京,北京大学第一医院内分泌科(钱荣立);卫生部北京医院内分泌科(金世鑫)
【提要】微RNAs是由19~23个核苷酸组成的RNA分子。它们能够中止mRNAs的翻译或降解mRNA,从而成为蛋白质表达的调控者。微RNAs能有力推进细胞的分化和发育。这种调节的异常相关β细胞生物学、胰岛素抵抗和糖尿病及其并发症。微RNA-375直接参与胰岛素分泌的调控。本研究证明,微RNAs密切相关于疾病的表现。近年新鉴定出一大批与疾病致病有关的微RNAs。本文所提供31种微RNAs的应用,仅作为研究案例如糖尿病肾病发病的趣谈,旨在引起《中国糖尿病杂志》读者和作者研究微RNAs的浓厚兴趣。
【关键词】微RNAs;信使RNA;胰岛素抵抗;糖尿病
A new frontier for the research of diabetic molecular biology: A microRNAs application in β-cell biology, insulin resistance, diabetes and its complicationsQIAN Rong-li, JIN Shi-xin. Department of Endocrinology, Peking University First Hospital, Beijing 100034,China
【Summary】MicroRNAs (miRNAs) are small 19-23 nucleotide RNA molecules that act as regulators of protein expression by inducing the translational arrest and degradation of messenger RNAs. They are potent drivers of differentiation and development of cells, and their dysregulation has been linked to β-cell biology, insulin resistance, diabetes and its complications. The miR-375 is directly involved in the regulation of insulin secretion. This study demonstrates that a miRNA could be tightly linked to disease phenotypes. In recent years, dozens of additional miRNAs have been identified as components of pathological pathways. This compile provides 31 miRNAs’ application in researches and some pathways of diabetic nephropathy as interesting samples. The purpose of this paper is to introduce a great interests of the readers and authors of CJD on miRNAs research..
【Key words】 MicroRNAs (miRNAs); Messenger RNAs; Insulin resistance; Diabetes
微RNAs(miRNAs)在人体是近10年才被确认的一种新的内源性的小分子(19~23个核苷酸)单链、非编码RNA分子家族,为真核细胞蛋白表达的调控因子,通过对基因表达的转录过程的抑制,调控细胞的分化与发育的生理和病理过程,因而其调控异常与许多疾病有关。miRNAs的作用是通过miRNAs的5′端的“种子序列”(seed sequence)与位于靶基因信使RNA 3′端非翻译区(UTR)的互补靶点的不完全结合而发挥生物效应。每一个miRNA片断能抑制多个基因的表达,同时每个信使RNA也可与多个miRNAs结合。最新研究已证实miRNAs在T1DM和T2DM的β细胞生物学、胰岛素抵抗(IR)、糖尿病及其并发症(DC)中的作用和影响(表1)。本文拟就糖尿病研究的这一新领域作一初步介绍以期引起读者的关注。

一、miRNAs与β细胞生物学
已发现一批涉及β细胞生物学的miRNAs,部分如表1所列。尽管其中有些还需要进一步研究,但已清楚这些分子片断的突变和错误表达能导致β细胞病变。在成年人β细胞中,高血糖引起miR-375水平降低。当miR-375水平降低时通过对其靶物Mtpn和PDK1的脱抑制作用引起胰岛素分泌,而当miR-375表达过度时将减少细胞增生和胰岛素基因转录,同时减少葡萄糖引起的胰岛素分泌。miR-375在糖尿病胰岛β细胞的异位表达,会增加对脂肪酸的易感性而引起细胞凋亡。此外肥胖糖尿病鼠(ob/ob)和T2DM患者胰岛miR-375水平升高。miR-375靶向作用的一组基因能对细胞的生长增殖呈负调控,该miRNA异常丢失将导致β细胞大量减少、胰岛素水平低、高血糖和糖尿病。另外报道miR-9正调控葡萄糖引起β细胞的胰岛素分泌,通过直接抑制Onecut-2,一种颗粒蛋白抑制因子(突触样蛋白-4),这种蛋白明显增强基础分泌但抑制K离子引起的胰岛素分泌。同样miR-96通过突触蛋白样-4(synaptotagmin-like 4)负调控β细胞的胰岛素胞泌作用;miR-124a是第1个涉及神经发育的脑特异性miRNA,它通过胞泌途径连系β细胞与神经系统,在β细胞有葡萄糖存在时呈升调节,β细胞内高水平的miR-124a导致低血糖引起的胰岛素恶性释放,但减低葡萄糖引起的胰岛素分泌。另外miR-7和miR-375都在脑和β细胞表达,β细胞和神经原分享相似的分泌机制和应答血糖与胰岛素的信号,说明胰岛素刺激大脑主要是脑皮质的糖代谢,大脑miRNAs的表达受到糖尿病的损害,因而引起神经病变的后果。
二、miRNAs与肥胖脂肪组织和胰岛素抵抗
研究发现,脂肪组织的miRNAs在应答肥胖引起的分子改变和环境信号时明显调控异常,如脂肪组织的高血糖和高胰岛素血症引起miR-29家族表达,应答高血糖,3T3-L1脂肪细胞miR-29a高度上调。miR-320增加胰岛素抵抗细胞对胰岛素的敏感性,而miR-27b则损害人脂肪细胞的分化。这些miRNAs靶向作用能保护受肥胖和糖尿病损害的局部和全身的核心细胞调控通道。miR-320靶向作用于p85,通过增加Akt磷酸化和Glut-4水平对细胞生长起关键作用。miR-27b靶向调控PPAR-γ。某些脂肪生成引起的miRNAs在肥胖时呈降调节,如抑制miR-143能调控细胞分化,减少脂肪生成;而miR-103和miR-107促进脂肪生成。用TNF-α治疗1 d后脂肪细胞的miR-143,103和107都减低,提示巨噬细胞浸润和细胞因子释放参与减少肥胖者的脂肪生成。一项研究观察到糖尿病GK鼠模型肌肉、脂肪、肝组织的多个miR-29家族的表达增加与胰岛素抵抗有关。
三、miRNAs与糖尿病并发症
大量临床与实验研究报道miRNAs与糖尿病血管并发症的关系,特别是关于糖尿病肾病变(DN)与miRNAs的研究(图1)
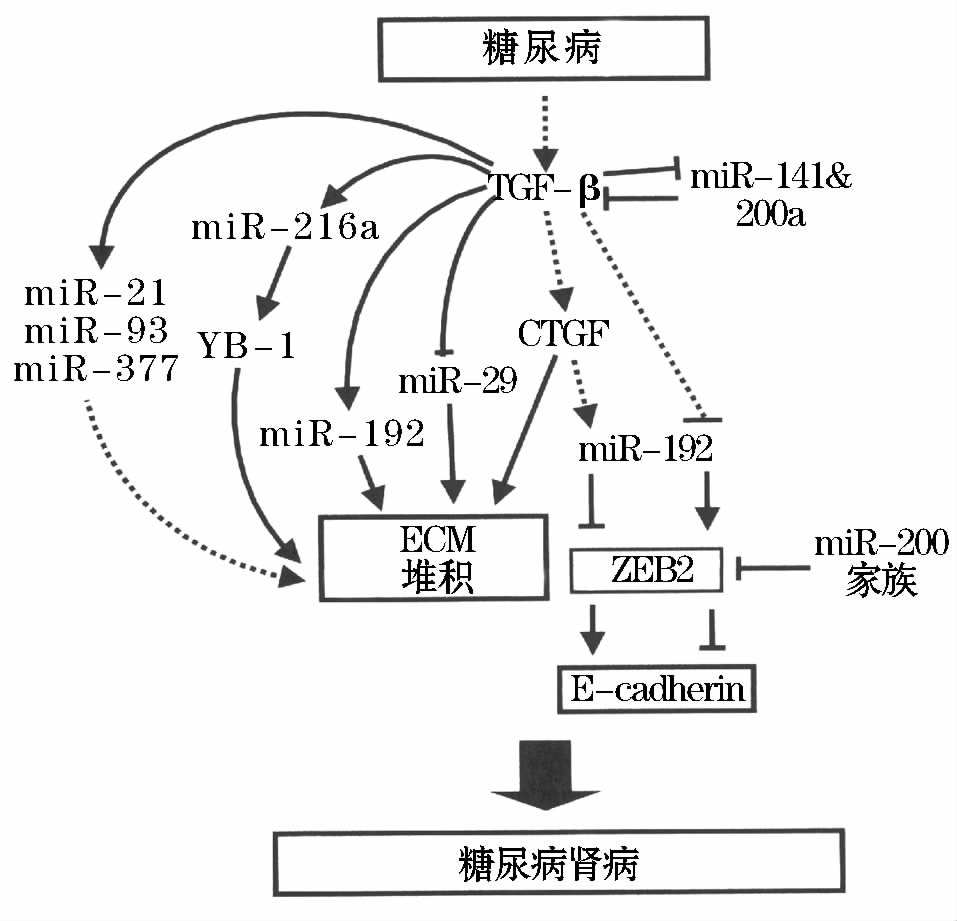
图1总结已知在糖尿病肾病发生发展中有作用的miRNAs 多个miRNAs通过其特异性靶点直接与DN病变联系,只有miR-192显示为双重作用
注:TGF-β:转化生长因子β;ECM:细胞外基质;CTGF:结缔组织生长因子;E-cadherin:上皮钙依赖性粘连蛋白
四、miRNAs与心脏
尽管对糖尿病心肌病变的特点还不完全了解,但心脏肥大和收缩功能异常最终可导致心衰。目前更多关注miR-133与糖尿病心肌病变,因为miR-133在心脏表达丰富,是心肌生长的调控因子,明显参与心脏病变,但miR-133对糖尿病心脏的作用呈双重性,取决于其表达增加还是减低,它们在糖尿病如何取得平衡仍是谜。miR-133在心脏水平增高取决于血清应答因子(SRF),后者在糖尿病心脏增高。敲除SRF可预防miR-133表达增加,而SRF的心脏特异调控异常可引起心脏肥大和其他类似于早期充血性心衰的心脏病变。而miR-133心脏表达增加的后果是干扰心脏的传导性,如糖尿病患者Q-T间期延长,即长QT综合征(LQTS)代表心肌除极和复极,是通过K+通道的离子流控制,受人ERG基因调控,在糖尿病心肌细胞呈降调节。而ERG miRNA的3′UTR是miR-133的靶物。降低miR-133的心脏表达相关于心脏肥大。增厚的心肌使心室缩小,心排量减少。miR-133过度表达抑制心脏肥大,而抑制miR-133则引起更明显的心肌肥大。miR-320水平升高可调控几种糖尿病心肌微血管内皮细胞的血管生成因子,包括血管内皮生长因子、成纤维细胞生长因子、IGF-1和IGF-1的受体。所有这些因子均密切相关于糖尿病心肌病。miR-320表达增加和相应的IGT-1和IGT-1受体表达降低,在糖尿病血管生成损害中可能起作用。
五、展望
如表1所列,已发现一大批与糖尿病有关的miRNAs改变,成为深入研究糖尿病的新领域。如大脑与胰岛素靶组织间的相互作用,尽管大脑营养主要靠葡萄糖,但过去认为脑组织对胰岛素不敏感。最近报道在大脑特定区域胰岛素引起葡萄糖摄取,而研究显示miRNAs对于大脑的主要调节功能,在大脑miRNAs反映高血糖、高血脂的改变,这对系统全面了解糖尿病是非常重要的。另外现已清楚在胰岛素抵抗组织的miRNA指标,在糖尿病发病或诊断前数年就已有改变。如Zampetaki等指出5种miRNAs(即miR-15a、miR-296、miR-126、miR223和miR-28、miR-3p)能准确的鉴别糖尿病高危者和健康人,显然这些miRNAs不仅可以预测发病早期,而且也反映疾病的进展,是进行早期干预的好标靶。也证明某些miRNAs在糖尿病并发症发生中的作用,发生在那些位点,证明某些miRNAs表达的增加或减少两者均关系到糖尿病并发症。另外由于某些人对发生T2DM有高度遗传易感性,确认遗传变异,改变关键的miRNAs水平,将成为临床强有力的工具。我们预期这项技术将提供给临床医生非常宝贵的工具,以确认处于高危的患者,促使他们采取预防措施以致有针对性的治疗。无疑开发这项技术阻断或增加miRNAs的表达作为预防和治疗人类疾病的新技术也将具有很大经济效益。
(编译自Diabetes 60:1825~1831,2011 and Diabetes 60:1832~1837,2011)
(收稿日期:2011-09-07)
(本文编辑:董兵)
版权所有:《中国糖尿病杂志》社 主管单位:中华人民共和国教育部 主办单位:北京大学
地址:北京市西城区大红罗厂街1号 邮编:100034 电话(传真):010-88505683
中国糖尿病杂志社版权所 京ICP备11029051号-1 Powered by JiuduCMS 技术支持:九度创想